
上海奧法美嘉生物科技有限公司
 鉆石會員
鉆石會員 已認證
已認證

上海奧法美嘉生物科技有限公司
 鉆石會員
鉆石會員 已認證
已認證
介紹
本文隸屬于復雜制劑應用專題,全文共 7076 字,閱讀大約需要 18 分鐘
摘要:疫苗中亞可見顆粒的存在對產品的安全性、有效性及質量一致性具有重要影響。這些顆粒可能來源于蛋白質聚集、乳化劑聚集或外源性微粒,盡管尺寸處于亞可見范圍,仍可能誘發免疫反應或注射部位不良反應。由于亞可見顆粒粒徑小、來源復雜、濃度低且易受配方干擾,傳統檢測手段難以實現準確量化。AccuSizer顆粒計數器憑借高靈敏度、寬動態范圍、高分辨率和快速測量的優勢,能夠有效解決疫苗亞可見顆粒檢測中的關鍵難題,為疫苗研發、質量控制及法規符合提供可靠工具。本文系統分析了亞可見顆粒的特性及其對疫苗質量的影響,總結了檢測難點,并探討了AccuSizer在相關應用中的優勢與實踐案例。
關鍵詞:疫苗;顆粒檢測;AccuSizer;亞可見顆粒
一、疫苗及顆粒概述
1.1 疫苗的類型
疫苗是一類用于預防感染性疾病的生物制品,其通過激發機體特異性免疫應答獲得免疫保護。按照制備原理的不同,常見的疫苗類型包括:
滅活疫苗:通過化學或物理方法滅活病原體,如滅活流感疫苗
減毒活疫苗:通過削弱病原體毒力制備,如麻疹疫苗
重組蛋白疫苗:利用重組技術表達特定抗原蛋白,如乙型肝炎疫苗
核酸疫苗:基于mRNA或DNA表達抗原蛋白,如部分新冠疫苗
不同類型疫苗中蛋白質含量、輔料成分和佐劑配比差異明顯,這直接影響顆粒形成和分布特性。
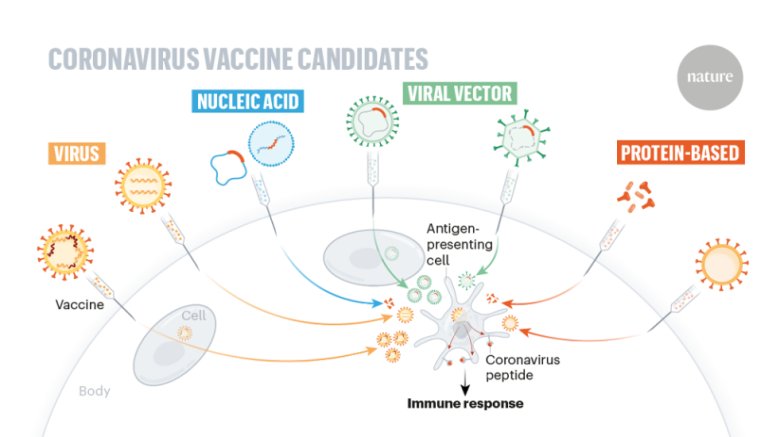
圖2:蛋白質不同聚集狀態的示意圖
1.2 疫苗中顆粒的來源
疫苗中的顆粒來源復雜,可依據不同劃分原則進行分類。按粒徑范圍,通常分為可見顆粒與亞可見顆粒;按來源,則可分為內源性顆粒與外源性顆粒。
1.2.1 內源性顆粒
內源性顆粒主要源于疫苗配方自身成分的理化變化。典型例子有蛋白質聚集體和乳化劑顆粒。
1.2.1.1蛋白質聚集體
蛋白質類疫苗在生產、運輸及儲存過程中極易受到物理、化學因素的影響,如溫度波動、凍融循環以及pH變化等。這些應激條件會導致蛋白質分子部分折疊或發生不可逆聚集,進而形成不同尺寸范圍的亞可見顆粒(subvisible particles, SVPs)[2,3]。如圖2展示了蛋白質在受到外界因素影響時,其結構變化形成蛋白質聚集體的過程。從初始的折疊、有序的蛋白質結構開始,經過一系列中間狀態,最終形成不同形式的聚集體。這一過程直觀地呈現了蛋白質類疫苗在不利環境下可能發生的結構改變,這些改變正是導致顆粒形成的原因。研究表明,這類顆粒不僅會降低疫苗制劑的長期穩定性,還可能增強其免疫原性,誘導機體產生非預期的免疫反應甚至免疫原性相關不良事件[4]。這些顆粒可能引起免疫原性增加或降低疫苗穩定性,對其進行有效監測和表征對于保證疫苗的安全性和療效至關重要。
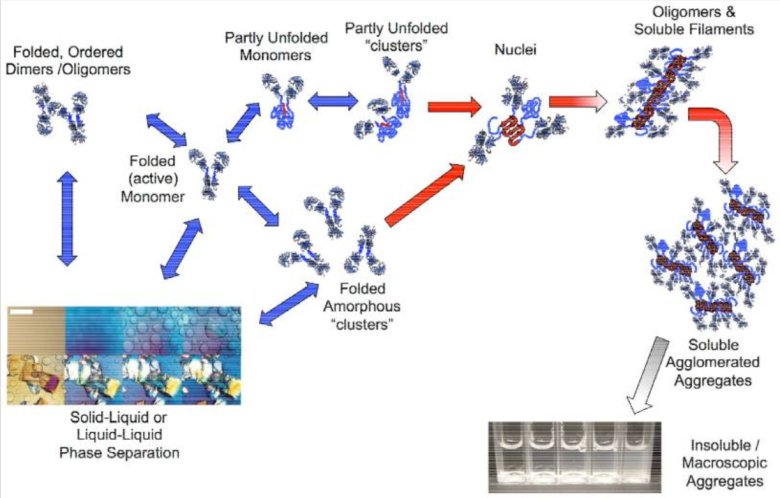
圖2:蛋白質不同聚集狀態的示意圖
1.2.1.2 乳化劑顆粒
油包水乳液型佐劑(如MF59、AS03)中的乳劑顆粒本身屬于功能性成分,通常處于亞微米級別,對疫苗的免疫增強效果具有重要作用。然而,在貯存或運輸過程中,乳劑顆粒可能發生聚集或粒徑異常增大,形成亞可見或不溶性大顆粒,進而影響制劑的物理穩定性與用藥安全性。若顆粒過大,易導致乳劑分層、聚集,并增加注射部位的不良反應風險;而顆粒尺寸若偏離預期范圍過小,則可能引起體內快速清除或免疫應答不足,均會削弱疫苗的有效性與安全性。以諾華乳佐劑專利(WO2011067669A2)為例,其中明確指出需對粒徑在1.2 μm以上的顆粒進行監控與定量分析,并制定了相應的測量標準。該專利采用AccuSizer系列顆粒計數器進行檢測,正是基于對大顆粒影響乳劑穩定性的考量。此類大顆粒的存在可能加劇聚集與分層現象,從而影響佐劑免疫效果的一致性與安全性[5]。該實例表明,AccuSizer在乳劑體系中對亞可見及不溶性大顆粒的高精度監測具有明確的應用價值。

圖3:諾華乳佐劑專利
1.2.2 外源性微粒
疫苗中的外源性微粒來源復雜,可能在生產、包裝、運輸、儲存、開啟及臨床使用的各個環節被引入。這進一步強調了嚴格控制微粒污染的必要性,以及在藥品包裝設計、操作流程規范和終端臨床使用中采取系統性風險控制措施的重要性。
圖4:可能引入外源性微粒途徑示意圖
案例分享:安瓿瓶不同打開方式與藥品微粒含量實驗及其結果;該實驗設置了三種不同的安瓿瓶打開方式作為研究變量,分別Our Method、常General Method以及Open adaptor。實驗過程中,嚴格遵循標準操作流程,實驗結果通過柱狀圖清晰呈現。

圖5:安瓿瓶不同打開方式操作示意圖
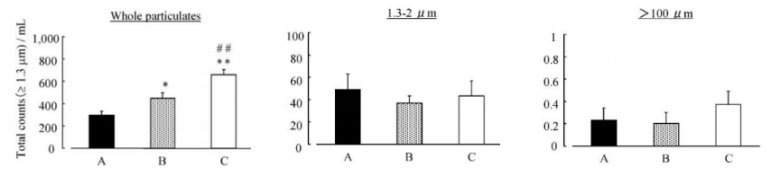
圖6:安瓿瓶A、B、C三種打開方式藥品微粒含量對比
從圖示結果可以看出,安瓿瓶玻璃在受力斷裂時,無論是使用開瓶器還是直接用手掰開安瓿瓶,都會在開啟過程中產生數量不等的微粒。
這些外源顆粒的存在給疫苗注射安全埋下了隱患,可能致使接種部位出現刺激癥狀、引發炎癥等不良后果。[6]
二、為什么需要關注疫苗中的顆粒
2.1. 對健康與免疫的影響
健康風險是疫苗安全性關注的核心。研究表明,疫苗用輔料(如蔗糖)中若存在不溶性微粒,可能激發異常的免疫應答。例如,基于小鼠腘窩淋巴結模型的實驗顯示,蔗糖中的不溶性微粒可引發免疫反應,提示在疫苗輔料的質量控制中需重視不溶性微粒的合理管控。[6]正常情況下,疫苗注射后機體會產生預期的免疫應答并伴隨一些輕微、正常的生理反應,但也可能出現異常情況。圖7直觀對比疫苗注射后機體的正常反應與異常反應:左側顯示注射后局部組織無異常炎癥表現,僅產生預期免疫應答和組織相關的輕微、正常生理反應;右側顯示可能會產生的血管栓塞風險、組織反應異常、過敏反應等伴隨的異常病理反應。隨著微粒進入機體循環,還可能引起更大的全身健康風險,如圖8所示。[7]
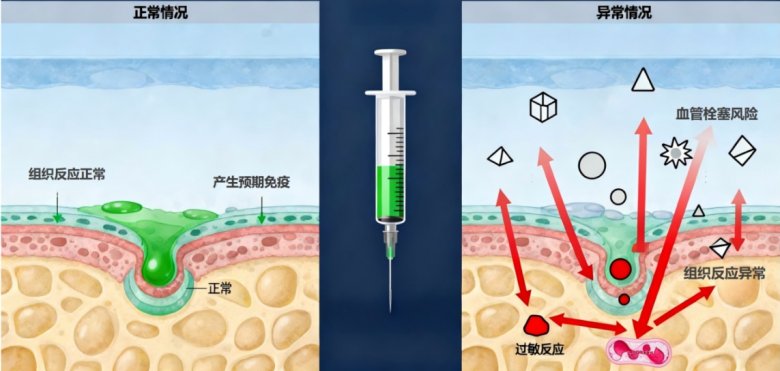
圖7:注射疫苗免疫反應對比圖
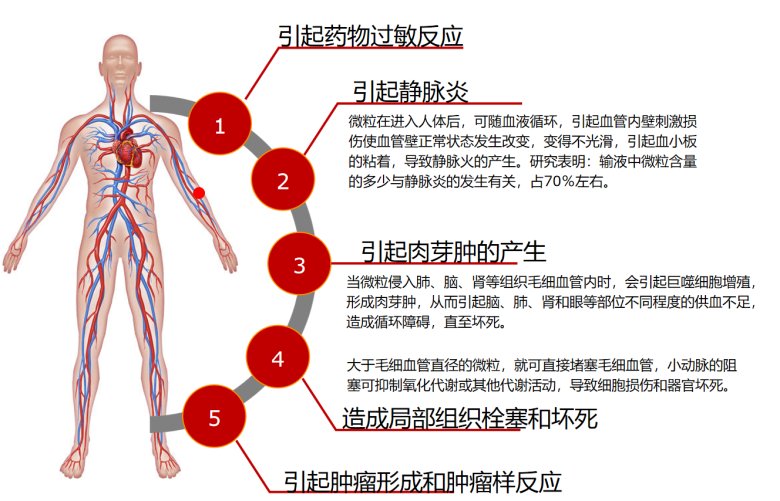
圖8:微粒引起健康風險圖示
2.2 疫苗有效性與制劑穩定性
疫苗中含有多種成分,其中不少是以蛋白質為基礎的物質,抗原便是典型的蛋白質成分。在疫苗的研發、生產和儲存過程中,由于各種因素(如溫度變化、pH 值波動、機械應力等)的影響,抗原蛋白質可能會發生聚集現象。蛋白質聚集可能改變抗原構象,降低疫苗誘導的特異性免疫應答。乳化劑顆粒分布不均則可能導致佐劑作用不穩定,影響免疫增強效果。[8]
如圖9所示:左側展示了典型的Y形抗體分子結構,正常情況下,其兩個臂端可與特定抗原實現特異性結合,這是啟動正常免疫應答的關鍵步驟。然而,右側呈現了抗原發生蛋白聚集后的狀態,大量抗原聚集形成較大的聚集體。這種聚集改變了抗原的原有結構和表位暴露情況,導致抗體無法與聚集后的抗原進行有效結合。一旦無法實現特異性結合,正常的免疫應答過程便無法啟動,在疫苗應用的情境下,也就意味著疫苗無法發揮預期的免疫效果,影響了其保護機體免受相應病原體侵害的能力。因此,對亞可見顆粒進行精確監控是保證疫苗免疫效果的關鍵環節。
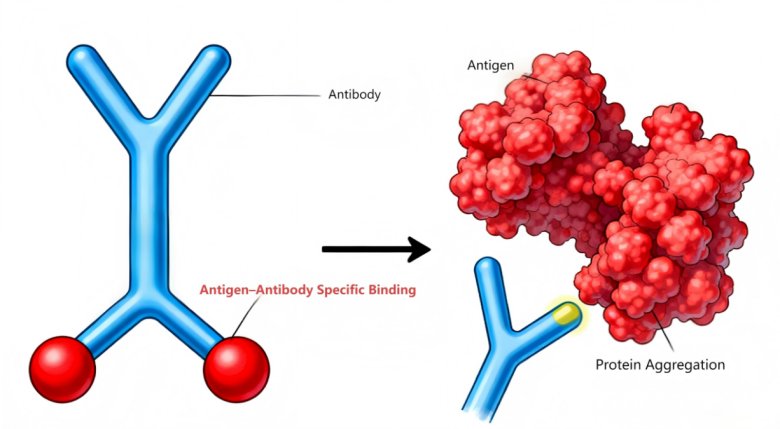
圖9:抗原抗體正常特異性結合及蛋白聚集導致的異常結合示意圖
2.3 監管需求
疫苗投入市場前,企業完成全部檢驗項目后,必須由國家藥品監管部門對每批疫苗的質量進行嚴格審核、檢驗。企業的質量自檢旨在確保疫苗的安全、有效、合規,涵蓋從原料到成品的每個環節,通過嚴格的質量控制,保障疫苗質量符合國家標準。[9]
我國自 2006 年開始對進口 MMR 制品實行批簽發全檢,2008 年開始對國產 MMR 制品實行批簽發資料審核與實驗室項目部分檢定。中國無進口MMR 制品后,國產 MMR 疫苗的批簽發數量明顯增加,見圖10。[10]
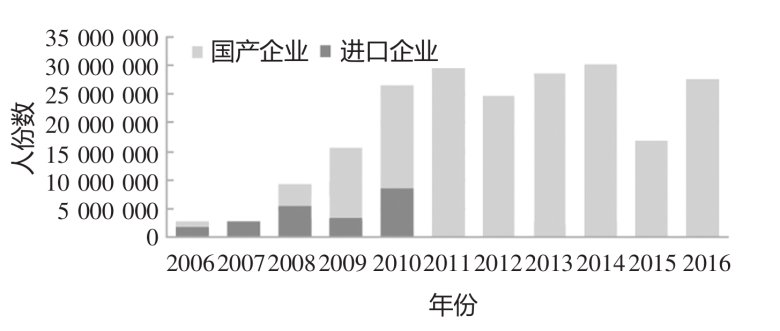
圖 10:2006~2016 年間 MMR 疫苗批簽發人份數統計
疫苗產量的大規模提升對疫苗的質量提出了嚴峻的考驗,維持疫苗的批間穩定性與一致性是保證疫苗有效性與安全性的關鍵。
2.4 法規要求
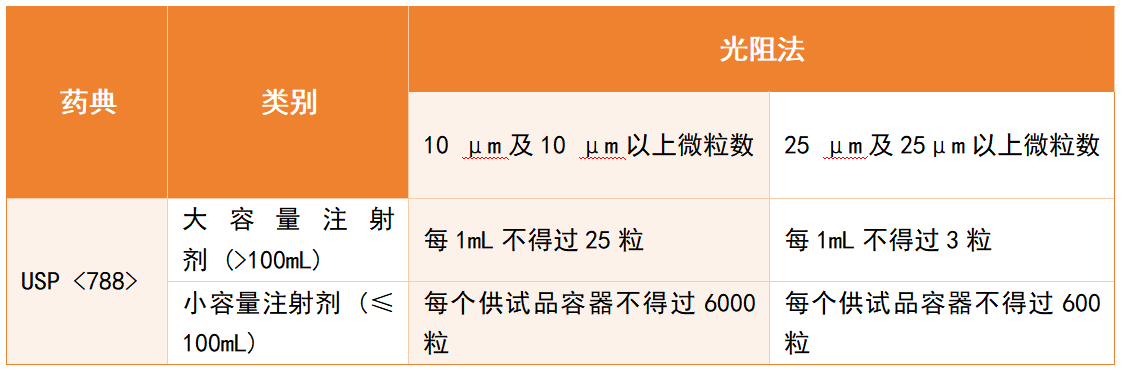
各國藥典對注射劑中的微粒均有嚴格要求,但檢測范圍和限值存在差異。以注射劑中不溶性微粒為例:美國藥典USP <788> 對注射劑≥10 μm和≥25 μm的顆粒設定了明確限值,見表格1。中國藥典(ChP):對不溶性微粒的檢測范圍相對較窄,主要針對部分常規注射劑,對特定類型疫苗或含佐劑的復雜制劑尚未完全涵蓋。雖藥典規定的“不溶性微粒”檢測僅覆蓋部分注射制劑,并非涵蓋所有類型的疫苗;但在疫苗研發與質量控制實踐中,企業已普遍將微粒監測納入關鍵檢測項目。這一趨勢正好反映了從“科學風險”到“法規要求”的轉化過程。[11][12]
表格1:USP <788>關于注射劑規定
三、疫苗顆粒檢測的難點
疫苗顆粒的物理化學特性會影響其穩定性、免疫原性和安全性。然而,疫苗制劑中顆粒體系的復雜性以及檢測環境的敏感性使得精準表征疫苗顆粒面臨多重技術挑戰。以下從顆粒來源、濃度、配方干擾及樣品制備四個維度,分析疫苗顆粒檢測的難點。
3.1 顆粒來源復雜
疫苗制劑中顆粒來源多樣,可分為內源性顆粒和外源性顆粒兩大類。不同來源的顆粒可能具有相似的粒徑或光學特性,但其潛在風險截然不同。這對檢測儀器的分辨率、檢測原理的針對性以及數據分析能力提出了極高要求。
3.2 樣品有限下的微量顆粒檢測難
在疫苗研發階段,可用于顆粒檢測的樣品通常非常有限,尤其是臨床前或早期研發樣品,無法進行大規模取樣。這就對檢測儀器提出了高要求:必須具備高靈敏度、低樣品消耗和精確量化能力,才能在微量樣品條件下準確監測顆粒,避免漏檢或誤判。
3.3 配方干擾
高蛋白濃度、鹽類或乳化劑可能影響光學或阻抗檢測信號,導致假陽性或假陰性結果,給檢測帶來挑戰。
3.4 樣品制備易改變顆粒狀態
稀釋、攪拌或溫度變化可能導致顆粒聚集或解聚,影響測量結果的準確性。因此,減少樣品制備干擾是確保檢測可靠性的關鍵。
四、AccuSizer在疫苗顆粒檢測中的優勢
疫苗顆粒檢測面臨多重挑戰,包括顆粒微小、濃度低、來源復雜、配方干擾以及法規要求嚴格。AccuSizer顆粒計數器在應對這些難點時具有多方面優勢,可以分為以下幾點:
4.1 微量進樣
疫苗樣品在研發、生產及質量控制過程中,有時可獲取的樣品體積較小。AccuSizer靈敏度高達10PPT級別,即使只有微量的顆粒通過傳感器,也可以精準檢測出來。確保即使在樣品量有限的情況下,也能全面評估疫苗的安全性和穩定性,避免因漏檢微量顆粒而影響疫苗質量
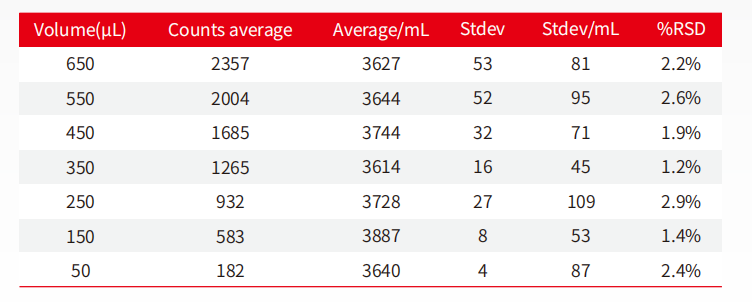
圖11:微量進樣不同體積精確性對比表
新版藥典USP<787>對于體積精度提出了苛刻的要求。AccuSizer 系列儀器對進樣體積、流速及計數準確性分辨率經過嚴格驗證,最小的進樣量可達50μL(依不同配置)。
從表中數據可以發現,從650μL至50μL所檢測的不同體積中,所得到的每毫升的顆粒數基本相同,其RSD值在50uL處依舊維持在2.4%,可見AccuSizer系列儀器在微量進樣的技術層面,依然可以提供精確的數據。
4.2 寬高濃度適應能力
AccuSizer系列顆粒計數器專為高濃度樣本的檢測提供解決方案。其獨特的設計理念特別適合高濃度樣本,搭配自動稀釋模塊更是可以檢測濃度高達1012#/mL的樣本。這使其適用于顆粒濃度變化較大的疫苗樣品,包括部分乳佐劑制劑。
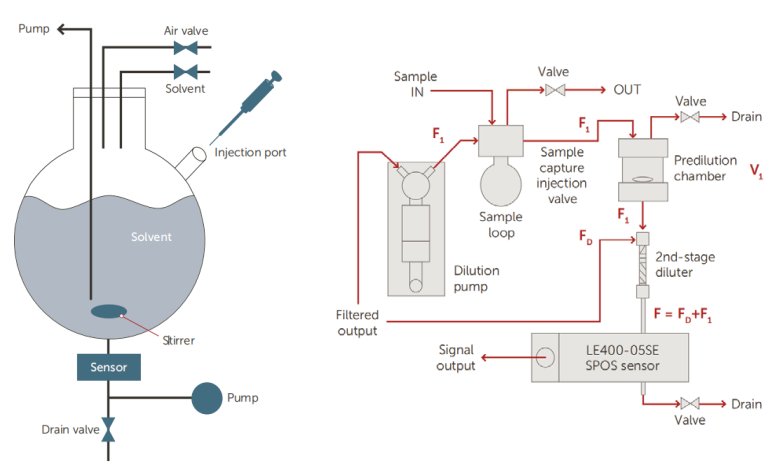
圖 12:自動稀釋系統原理圖 圖13:二步稀釋系統原理圖
如圖14所示AccuSizer系列顆粒計數器(分別應對LE、FX、Fxnano傳感器)測試數據結果,A7000 APS結果圖(LE傳感器)濃度高達: 3.72E+007 顆/mL。
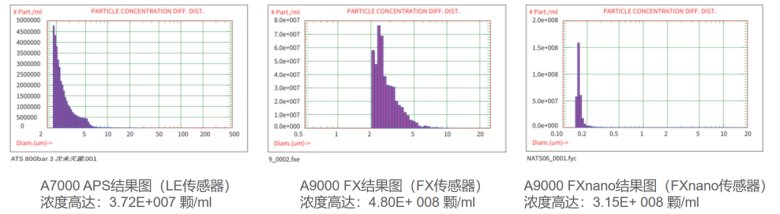
圖14:AccuSizer系列(分別應對LE、FX、Fxnano傳感器)測試數據結果
4.3 測試結果準確可靠
在高蛋白、高鹽或乳化劑復雜體系中,AccuSizer通過單顆粒光學傳感計數(Single Particle Optical Sizing,SPOS),可實現對分散體系中的不溶物微粒量化計數,減少配方干擾導致的假信號。這對于保證結果準確性和重復性至關重要。
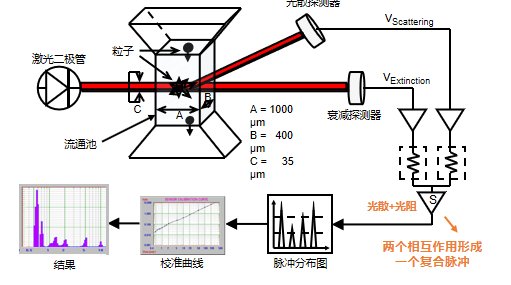
圖15:SPOS原理圖
4.4 符合國際法規
AccuSizer測量結果重復性高,可追溯性強,符合國內外藥典(如USP<788>及中國藥典2025版)對亞可見顆粒檢測的要求,可用于批次間對比和質量控制,為疫苗研發和生產提供可靠的數據支持。

圖16:CP0903 檢測報告

圖17:USP788 檢測報告
4.5 AccuSizer顆粒計數器系列
AccuSizer系列顆粒計數器通過搭配不同傳感器、進樣器,適配不同的樣本的測試需求,能快速而準確地測量顆粒粒徑以及顆粒數量/濃度的卓越伙伴。


總結
疫苗中的亞可見顆粒是影響其安全性與有效性的關鍵質量屬性。無論是蛋白質抗原的聚集體、乳佐劑的粒度分布,還是包材引入的外源性微粒,均需進行精準監控。AccuSizer系列顆粒計數器憑借其寬檢測范圍、高靈敏度及符合國際標準的檢測方法,能夠在疫苗研發、生產、質控和穩定性研究的各個階段發揮作用。未來,隨著疫苗平臺的不斷更新和監管要求的日益嚴格,AccuSizer將在全球疫苗行業中繼續發揮重要作用,為提升公共衛生安全提供技術保障。
參考文獻
[1]
[2] Sharma DK, King D, Oma P, Merchant C. Micro-Flow Imaging: Flow Microscopy Applied to Sub-Visible Particulate Analysis in Protein Formulations. AAPS J. 2010;12(3):455–64.
[3] European Pharmacopoeia. Sub-visible particulate contamination: Ph. Eur. 10.0, 2.9.19. 2020.
[4] Wang W. Protein aggregation and its inhibition in biopharmaceutics. International Journal of Pharmaceutics. 2005;289(1-2):1–30.
[5] Novartis AG. WO2011067669A2
[6] 王玨,江穎,沈雁,等.基于小鼠腘窩淋巴結模型對疫苗用輔料蔗糖中不溶性微粒激發免疫應答風險的評估[J].藥物生物技術,2022,29(03):234-238.
[7]彭姝,張軍,李慧芬等.輸液中不溶性微粒的危害綜述[J].中國藥事,2018,32(08):1058-1063.
[8] Rosenberg AS. Effects of protein aggregates: an immunologic perspective. AAPS J. 2006;8(3):E501–E507.
[9] 周雅潔,聶建輝,黃維金,等.國內外疫苗批簽發管理概述[J].中國食品藥品監管,2025,(02):92-103.
[10] 崔曉雨,李薇,權婭茹,等.麻腮風聯合減毒活疫苗2014~2016年批簽發質量分析[J].中國生物制品學雜志,2017.[11] USP <788>. Particulate matter in injections. 2023.
[12] 中國藥典2025版. 注射劑不溶性微粒檢測要求.
相關產品
更多
相關文章
更多
技術文章
2025-08-20技術文章
2025-08-14技術文章
2025-04-18技術文章
2025-04-18
虛擬號將在 秒后失效
使用微信掃碼撥號